Europäisches Health Technology Assessment (EU HTA)
Mit der Einführung des EU HTA-Prozesses treten neue Anforderungen für die Nutzenbewertung von Arzneimitteln und Medizinprodukten in Kraft. Der einheitliche europäische Bewertungsprozess bringt Chancen, aber auch Herausforderungen mit sich.
Um den EU HTA-Prozess erfolgreich zu meistern, sind vorausschauende Planung, Flexibilität sowie ein tiefes und umfassendes Verständnis der regulatorischen Anforderungen essenziell.
Seit 2015 gestaltet AMS den EU HTA-Prozess aktiv mit – durch regelmäßige Beiträge auf Kongressen, Publikationen, Teilnahmen an EU HTA-Veranstaltungen und als EUCOPE-Mitglied. Unsere praktische Erfahrung und fundierte Expertise, die wir unter anderem während der Erstellung und Einreichung von rapid Relative Effectiveness Assessment (REA) Submission Files im Rahmen der EUnetHTA Joint Action 3 erworben haben, bringen Sie optimal vorbereitet und sicher durch den EU HTA-Prozess. Hinzu kommen zahlreiche Projekte zur inhaltlichen und strukturellen Vorbereitung auf den EU HTA-Prozess – durch PICO-Antizipationen und Machbarkeitsanalysen für indirekte Vergleiche sowie Trainings von Teams, um optimierte Arbeitsabläufe und die interdisziplinäre Zusammenarbeit zu gewährleisten.
Nutzen Sie unser Wissen, um die Anforderungen des neuen EU HTA-Prozesses strategisch zu erfüllen und erfolgreich in Ihrem Unternehmen umzusetzen.
Dr. Jana Maurer
Deputy Director Medical Science
Jana begann ihre Karriere mit einer Promotion (Dr. rer. nat.) in der Grundlagenforschung zu chronisch entzündlichen Darmerkrankungen an der Technischen Universität München. Seit 2014 ist sie bei AMS Expertin im Bereich Medical Writing und strategische Beratung mit einem besonderen Fokus auf HTA (EU HTA & AMNOG). Sie berät Unternehmen strategisch bei der Entwicklung einer produktspezifischen Market Access Strategie und im Rahmen der Erstellung von HTA-Dossiers für Arzneimittel und Medizinprodukte. Mit ihren Schreib- und Präsentationsfähigkeiten trägt sie als Senior Medical Writer dazu bei, wissenschaftliche Inhalte klar und nachvollziehbar darzustellen – von der Erstellung von HTA-Dossiers über peer-reviewed Publikationen bis hin zu mündlichen und Posterpräsentationen. Bereits seit über 20 Jahren führt sie erfolgreich interdisziplinäre Teams, darunter das Medical Writing-Team und das EU HTA-Team von AMS. Zwischen 2015 und 2017 leitete sie außerdem das Geschäftsfeld Market Access für Medizinprodukte, welches sich auf die Erstattung von Medizinprodukten in Deutschland konzentrierte. Seit 2022 verantwortet sie als Deputy Director der Abteilung Medical Science die Bereiche Geschäftsentwicklung und Kundenbeziehungen mit.
Unsere Ansprechpartnerin

Dr. Jana Maurer
Deputy Director Medical Science
Unsere Leistungen
Individuelles Playbook für den EU HTA-Prozess
Der EU HTA-Prozess stellt Unternehmen vor neue Herausforderungen – wir helfen Ihnen, optimal vorbereitet zu sein. Gemeinsam mit Ihnen entwickeln wir ein strukturiertes und praxisnahes Playbook, welches Ihre zentralen Funktionen – Clinical Development, Regulatory Affairs und Market Access – effizient auf die Anforderungen abstimmt.
EU HTA Training
Werden Sie fit für den EU HTA-Prozess – mit unserem Expertenwissen.
Wir stärken Ihre Kompetenz im EU HTA-Prozess. Wir teilen unser Know-how mit Ihnen – praxisnah, individuell und verständlich. Ob in maßgeschneiderten Workshops, praxisnahen Präsentationen oder informativen Publikationen – wir machen Sie bereit für den EU HTA-Prozess. Profitieren Sie von unserem Fachwissen und meistern Sie die Herausforderungen des EU HTA mit Sicherheit und Strategie.
Professionelle Unterstützung bei der Erstellung von Briefing-Dokumenten
Die Erstellung von Briefing-Dokumenten für die europäische Beratung (wie Joint Scientific Consultation, JSC), die Parallel Consultation (EMA und lokale HTA-Behörden) oder die nationale Beratung sind entscheidende Schritte für den Erfolg Ihrer Market Access Strategie. Wir unterstützen Sie bei der pragmatischen und zielgerichteten Ausarbeitung dieser Dokumente, um sicherzustellen, dass Ihre Anliegen klar und überzeugend kommuniziert werden. Vertrauen Sie auf unsere Expertise, um Ihre Beratungsgespräche erfolgreich und effizient zu gestalten.
Antizipation des Assessment Scopes (PICO-Antizipation)
Ein realistischer Zeitplan für Ihr EU HTA-Dossier erfordert eine frühzeitige Antizipation des Assessment Scopes der EU HTA Coordination Group. Wir unterstützen Sie dabei, diesen präzise vorherzusagen – für eine proaktive Evidenzgenerierung und zielgerichtete Dossier-Erstellung.
Genaue Kenntnisse europäischer HTA-Anforderungen
Wir beraten Sie gerne zur Evidenzgenerierung (z.B. Studiendesign, Endpunkte, Subgruppen- oder Sensitivitätsanalysen, Netzwerk-Meta-Analysen, Surrogatvalidierung, indirekte Vergleiche).
Evidenzgenerierung für Ihr EU HTA Dossier wissenschaftlich, methodologisch & strategisch
Vergleichende Evidenz ist entscheidend für die Bewertung der vielfältigen Anforderungen im Assessment Scope. Mit Hilfe von systematischen Literaturrecherchen (SLR) und Studienregistersuchen sichten wir den Evidenzraum und identifizieren relevante Studien für das EU HTA-Dossier. Evidenzsynthesen und post hoc-Analysen sind zentrale Erfolgsfaktoren im HTA-Prozess – und wir sind Ihre Experten für fundierte Analysen.
Erstellung eines maßgeschneiderten EU HTA-Dossiers – strategisch & wissenschaftlich fundiert
Ein überzeugendes EU HTA-Dossier ist entscheidend für den Erfolg im Joint Clinical Assessment (JCA) und schafft damit die bestmöglichen Voraussetzungen bei der Preisgestaltung auf nationaler Ebene. In enger Abstimmung mit Ihnen entwickeln wir ein wissenschaftlich fundiertes, strategisch ausgefeiltes Dossier, das Ihre Evidenz optimal präsentiert und die Anforderungen der EU HTA-Regularien erfüllt.
Optimierter Gesamtprozess für EU HTA und nationales HTA (Bsp. AMNOG-Dossier)
Mit unserer umfassenden Erfahrung in der parallelen Erstellung von europäischen und nationalen HTA-Dossiers für Deutschland, bieten wir Ihnen einen effizienten und abgestimmten Ansatz. Wir helfen Ihnen, die unterschiedlichen HTA-Prozesse zu kombinieren und einen synergistischen Gesamtprozess zu entwickeln, der Zeit spart und Ressourcen optimal nutzt.
Umstellung vom nationalen zum EU HTA: Wann erfolgt die Umstellung?
Seit Januar 2025 wird die Verordnung über die europäische Bewertung von Gesundheitstechnologien umgesetzt. Die klinischen Domänen eines HTA von neu zugelassenen Arzneimitteln werden danach auf europäischer statt auf nationaler Ebene erstellt: das EU HTA. Für verschiedene Arzneimittel wird die Nutzenbewertung auf EU-Ebene (Joint Clinical Assessment, JCA) zu unterschiedlichen Zeitpunkten obligatorisch. Ab 2030 sind JCAs schließlich für alle Arzneimittel verpflichtend.
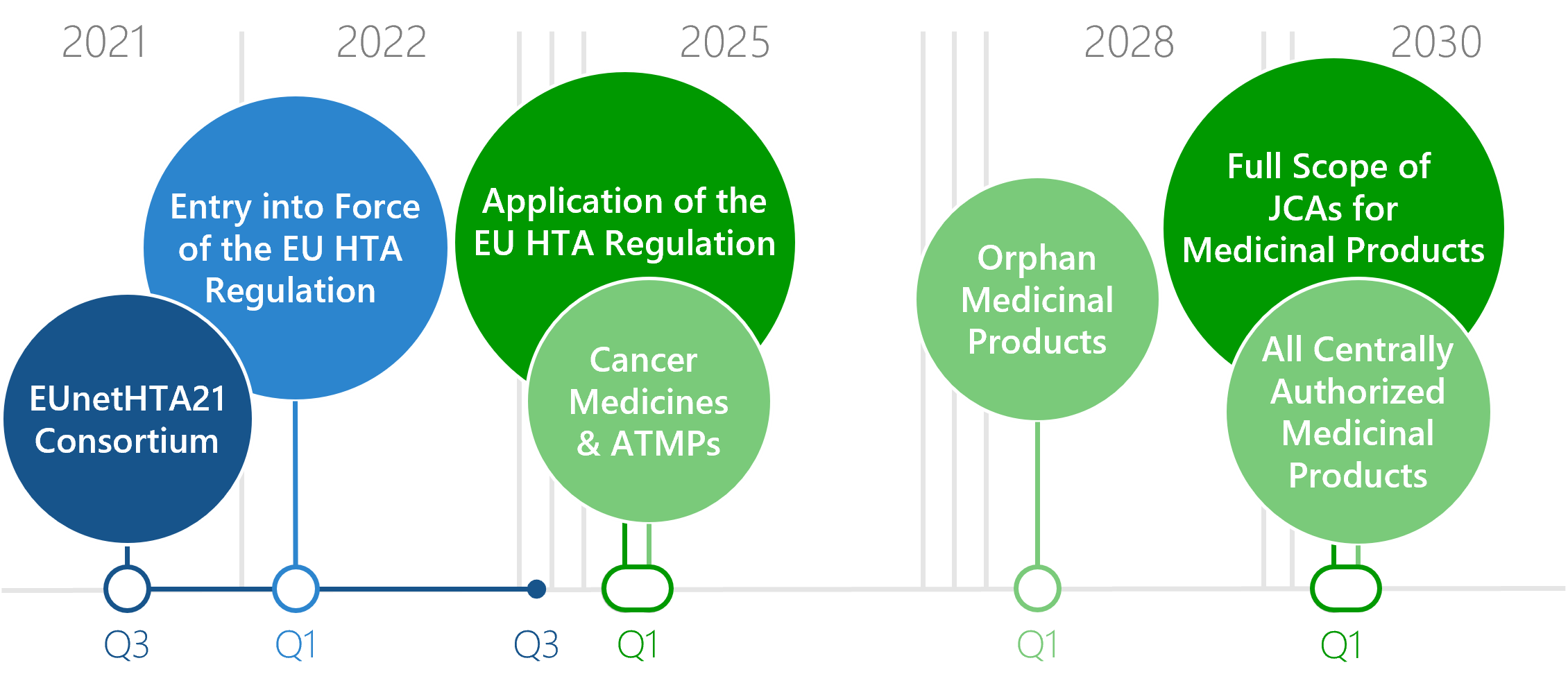
Download: Flyer Timelines Inkrafttreten des EU HTA
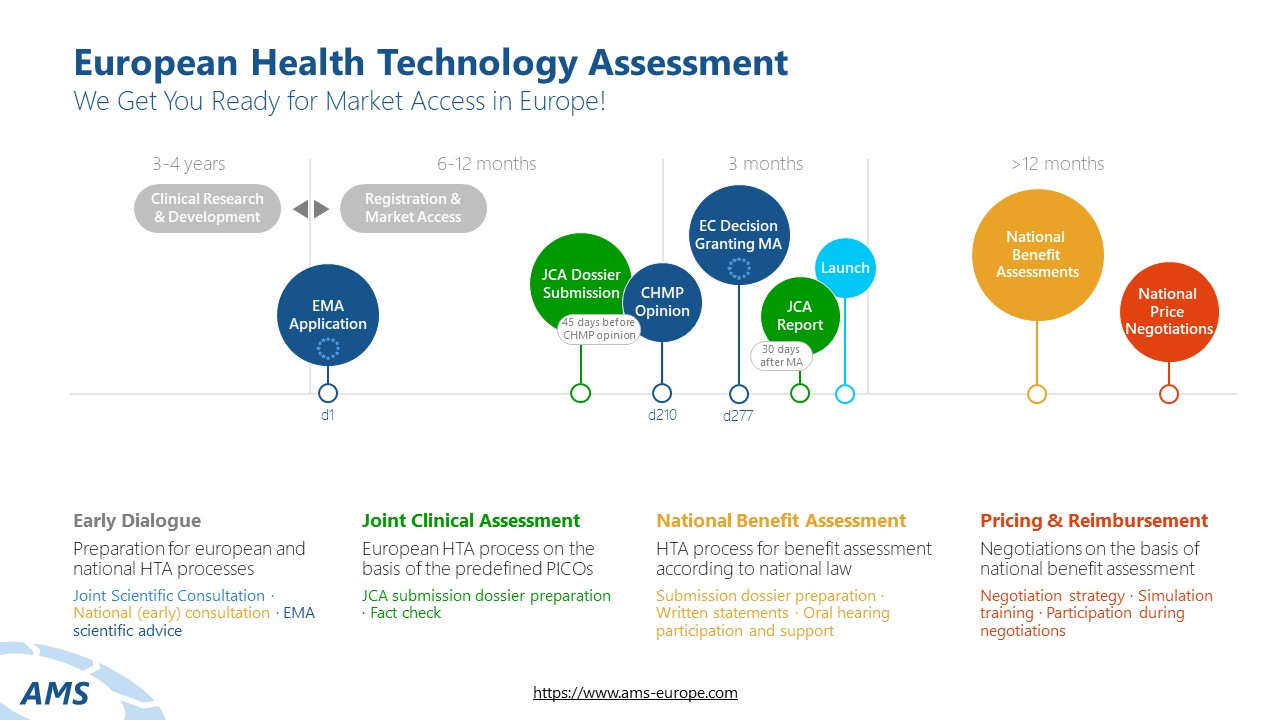
Ablauf des Joint Clinical Assessment
Das JCA ist ein zentraler Bestandteil des EU HTA-Verfahrens und standardisiert die klinische Bewertung von Gesundheitstechnologien auf europäischer Ebene. Es wird von der HTA-Koordinierungsgruppe der Mitgliedstaaten überwacht. Das JCA-Dossier umfasst Daten zur relativen Wirksamkeit und Sicherheit und muss spätestens 45 Tage vor der CHMP Opinion eingereicht werden. Nach eingehender Prüfung der eingereichten Informationen durch die Assessoren, wird der JCA-Report spätestens 30 Tage nach der Marktzulassung des Arzneimittels durch die EMA veröffentlicht und den nationalen HTA-Behörden zur Verfügung gestellt.
PICO-Scoping zum Assessment Scope
Vor Einreichung des JCA Dossiers wird ein Scoping-Prozess innerhalb der EU HTA Koordinierungsgruppe durchgeführt. Die Ergebnisse dieses Prozesses bilden die Forschungsfrage und den Bewertungsumfang für das Dossier. Der Scoping-Prozess zielt darauf ab, die PICOs (Population, Intervention, Comparator, Outcomes) zu definieren (Assessment Scope), die den Rahmen für die Bewertung und die Datenanforderungen an den Hersteller bestimmen.
JCA-Dossier-Erstellung
Nach der Bekanntgabe des Assessment Scopes stehen für die Dossiererstellung in der Regel nur 100 Tage zur Verfügung. Das JCA-Dossier beinhaltet eine systematische Evidenzaufbereitung und beantwortet die im Assessment Scope festgelegten Fragestellungen zur relativen Wirksamkeit und Sicherheit. Als zentrale Evidenzbasis für den JCA-Report enthält das Dossier die relevanten klinischen Studien – einschließlich direkter und indirekter Vergleiche – und ermöglicht eine wissenschaftlich fundierte Nutzenbewertung.
Evidenzgenerierung für Ihr EU HTA Dossier wissenschaftlich, methodologisch & strategisch
Vergleichende Evidenz ist entscheidend für die Bewertung der vielfältigen Anforderungen im Assessment Scope. Mit Hilfe von systematischen Literaturrecherchen (SLR) und Studienregistersuchen sichten wir den Evidenzraum und identifizieren relevante Studien für das EU HTA-Dossier. Evidenzsynthesen und post hoc-Analysen sind zentrale Erfolgsfaktoren im HTA-Prozess – und wir sind Ihre Experten für fundierte Analysen. Ob systematische Recherchen nach relevanten Studien, Endpunkteauswahl oder Surrogatvalidierung, Subgruppen- oder Sensitivitätsanalysen, Netzwerk-Meta-Analysen oder indirekte Vergleiche – wir beraten Sie umfassend zu den HTA-Anforderungen. Gemeinsam mit Ihnen entwickeln wir eine maßgeschneiderte Datenstrategie, die Ihre wissenschaftlichen, regulatorischen und wirtschaftlichen Ziele unterstützt. Zusätzlich bieten wir komplementäre Analysen auf Basis von Primärdatensätzen (ADaM) sowie vielfältige Evidenzsynthesen – Beratung, Berechnung und Interpretation – aus einer Hand. Durch den gezielten Einsatz von Visualisierungstechniken machen wir komplexe Daten greifbar und schaffen die Grundlage für HTA-Entscheidungsprozesse.

Originalartikel in Fachzeitschriften
- Eberle, K.; Hagemann, L.-M.; Schweitzer, M.K.; Justl, M.; Maurer, J.; Carls, A.; Reuter, E.-M. The PICO Puzzle: Can Public Data Predict EU HTA Expectations for All EU Countries? J. Mark. Access Health Policy 2025, 13, 32. https://doi.org/10.3390/jmahp13030032
- Schweitzer MK, Dold MN, Genet A, Gossens K, Klein-Hessling T, Löffler N, Rabel M, Rasch A, Reuter EM, Schmelcher J, Wolfram N, Werner S (2023). Shaping a suitable EU HTA dossier template: why the German template is not fit for purpose. Eur J Health Econ. 2023 Oct 16. doi: 1007/s10198-023-01631-5
- Schweitzer MK, Dold MN, Genet A, Gossens K, Klein-Hessling T, Löffler N, Rabel M, Rasch A, Schmelcher J, Werner S, Wolfram N (2023). Auswirkungen der neuen Dossieranforderungen Monitor Versorgungsforschung 03/23, p26–30, doi: http://doi.org/10.24945/MVF.03.23.1866-0533.2500
- Genet A, Bogner K, Goertz R, Böhme S, Leverkus F (2023). Safety analysis of new medications in clinical trials: A simulation study to assess the differences between cause-specific and subdistribution frameworks in the presence of competing events. Research Square. doi: 21203/rs.3.rs-2475247/v1
- Kisser A, Knieriemen J, Fasan A, Eberle K, Hogger S, Werner S, Taube T, Rasch A (2022). Towards compatibility of EUnetHTA JCA methodology and German HTA: a systematic comparison and recommendations from an industry perspective. Eur J Health Econ 23(5):863-878, doi: 1007/s10198-021-01400-2
- Wüstner S, Hogger S, Gartner-Freyer D, Lebioda A, Schley K, Leverkus F (2022). Clinical Evidence Informing Treatment Guidelines on Repurposed Drugs for Hospitalized Patients During the Early COVID-19 Pandemic: Corticosteroids, Anticoagulants, (Hydroxy)chloroquine. Front Public Health 18;10:804404, doi: 3389/fpubh.2022.804404
Weitere Publikationen (Workshops/Webinare/Präsentationen/Conference Abstracts)
- Reuter, E., Stein, L., Rittmeyer, C., Wüstner, S., Werner, S. (2025). More Similarities than Differences Methodological Approaches for Evidence Synthesis in EU and German HTA. Accepted for DIA Europe 2025. doi:26226/m.6756a9c308a81a4962784387
- Reuter E. Klein-Hessling T, Rittmeyer C, Schweitzer M.K., Werner S. (2024). PD149 Comparison Of The Draft European Union Health Technology Assessment Template With Germany’s AMNOG Template. International Journal of Technology Assessment in Health Care.;40(S1):S151-S151. doi:10.1017/S0266462324003829
- AMS (Reuter, E., Rua del Barrio, M.) (2025): EU HTA- Introduction to the new EU HTAR & Spanish HTA. BIOVAL Clúster BIO Comunidad Valenciana
- AMS (Reuter, E., Eberle K.) (2024): Auswirkungen der EU-HTA-Verordnung auf die Gesundheitsindustrie. BIOPRO Baden-Württemberg GmbH
Referenzen







