HTA Statistik
Evidenz strategisch generieren, analysieren und überzeugend kommunizieren
Wir beraten und unterstützen Sie vollumfänglich bei allen Fragestellungen rund um die Evidenzgenerierung, statistische Analysen und Ergebnispräsentation für das EU HTA und nationale Nutzenbewertungen. Unser Ziel ist es, die Anforderungen der HTA-Behörden optimal zu erfüllen und gleichzeitig Ihre Evidenzbasis strategisch so zu gestalten, dass sie die bestmöglichen Ergebnisse liefert. Damit Ihre Evidenz überzeugt, setzen wir auf eine breite Palette statistischer Analysemethoden.
Mit einem Team von über 24 Biostatistikerinnen und Biostatistikern begleiten wir Sie durch den gesamten HTA-Prozess – von der Machbarkeitsanalyse bis zur überzeugenden Präsentation Ihrer Daten.
Silke Seemüller
Director Biostatistics
Silke verfügt über mehr als 20 Jahre Erfahrung in der Biostatistik. Nach ihrem Abschluss als Diplom-Statistikerin im Jahr 2004 an der Ludwig-Maximilians-Universität München begann sie ihre Karriere an der Technischen Universität München in der Grundlagenforschung zur Multiplen Sklerose mit Schwerpunkt auf Datenmanagement und Statistik.
Seit 2010 ist Silke bei AMS tätig - zunächst als SAS-Programmiererin, später als Senior Biostatistikerin und ab 2017 als Associate Director Biostatistik. Im November 2024 übernahm sie die Leitung der Biostatistik als Direktorin.
Ihr Aufgabenbereich bei AMS umfasst neben der Kundenberatung insbesondere die Planung, Durchführung, Auswertung und Berichterstattung klinischer Studien der Phasen I bis IV sowie nicht-interventioneller Studien. Seit Inkrafttreten des Gesetzes zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung (AMNOG) ist sie zudem maßgeblich an der Erstellung von Nutzenbewertungen beteiligt. Sie trägt die Verantwortung für den statistischen Teil der Nutzendossiers und berät Kunden strategisch.
Unsere Ansprechpartnerin

Silke Seemüller
Director Biostatistics
Unsere Leistungen beinhalten
Beratung zur Evidenzstrategie
Wir beraten Sie zur optimalen Strategie zur Evidenzgenerierung entsprechend den HTA-Anforderungen und der Bewertungspraxis der HTA-Behörden. Wir identifizieren mögliche Evidenzlücken und erarbeiten Lösungen, um Ihre Datenbasis gezielt zu stärken. Wir konzipieren mit Ihnen statistische Analysepläne (SAP/Datenanforderung) für eine robuste Evidenzgrundlage.
HTA-spezifische Zusatzanalysen
Für Ihre Studien führen wir alle erforderlichen weiterführenden statistischen Analysen, wie beispielsweise Subgruppenanalysen oder weitere Datenschnitte auf Basis patientenindividueller Daten durch – nach CDISC ADaM-Standard und in Abstimmung mit den aktuellen Anforderungen der HTA-Behörden. Zudem setzen wir Machbarkeitsanalysen und Simulationsstudien auf, um gezielt spezifische Fragestellungen zu beantworten. Wir unterstützen Sie in der Kommunikation in Ihrem Unternehmen, den Behörden und weiteren Stakeholdern, um die gewonnenen Erkenntnisse effektiv weiterzugeben.
Evidenzsynthesen und weiterführende Analysen
Um den Wert Ihres Arzneimittels optimal zu quantifizieren, setzen wir eine breite Palette statistischer Analysemethoden ein. Abhängig von der Datenlage und dem Ziel der Analyse identifizieren wir das am besten geeignete statistische Modell, führen die Analysen durch und bereiten die Ergebnisse übersichtlich und überzeugend auf.
Datenworkshop mit visueller Dossiersimulation – ShinyViz
Ein überzeugendes Nutzendossier basiert auf einer klaren Datenstrategie. In unserem interaktiven Datenworkshop erarbeiten wir mit Ihnen eine Gesamtstrategie für Ihr HTA-Dossier.
AMNOG-Nutzenbewertung
Als Pionier im Jahr 2010 gestartet, ist AMS heute einer der Marktführer im Bereich der AMNOG-Nutzenbewertung – mit mehr als 300 Dossierprojekten in über 50 Indikationen. Unsere Kundinnen und Kunden schätzen unsere umfassende und tiefgehende statistische Expertise.
Europäisches HTA (EU HTA)
Bereits seit 2015 ist AMS im Bereich des EU HTA aktiv. Wir unterstützen Sie bei der Entwicklung eines Evidenzpakets für das EU HTA, indem wir Ihre Datenstrategie gezielt auf die Anforderungen des JCA ausrichten und die Vielfalt der PICO-Kriterien umfassend berücksichtigen. Mehr über unsere Expertise und Leistungen rund um das EU-HTA erfahren Sie hier.
Anwendungsbegleitende Datenerhebung (AbD)
Aufgrund unserer langjährigen Erfahrung sowohl bei klinischen Studien als auch im HTA können wir Sie optimal zur Studienplanung und statistischen Analyse der nicht randomisierten Vergleiche der AbD beraten. Von der Einleitung des Verfahrens über die Erstellung des Studienprotokolls und des statistischen Analyseplans bis hin zur Studiendurchführung, Zwischenanalysen und finaler Auswertung – wir begleiten Sie durch den gesamten Prozess. Mehr über unsere Expertise und Leistungen rund um die AbD erfahren Sie hier.
Evidenzsynthesen und weiterführende Analysen
Um den Wert Ihres Arzneimittels optimal zu quantifizieren, setzen wir eine breite Palette statistischer Analysemethoden ein. Abhängig von der Datenlage und dem Ziel der Analyse identifizieren wir das am besten geeignete statistische Modell, führen die Analysen durch und bereiten die Ergebnisse übersichtlich und überzeugend auf. Wir berechnen direkte und indirekte Vergleiche, darunter Meta-Analysen und Netzwerk-Meta-Analysen sowie MAIC, STC und ML-NMR zur Evidenzsynthese. Propensity Score Methoden und Kovarianzanpassungen minimieren Verzerrungen, während Überlebenszeitanalysen und multiple Regressionen entscheidende Einflussfaktoren berücksichtigen. Simulationsstudien und multiple Imputationen quantifizieren Unsicherheiten und stärken die Entscheidungsgrundlage.
So ermöglichen wir Ihnen fundierte Aussagen zu Wirksamkeit, Sicherheit und Lebensqualität im Kontext der Nutzenbewertung.

Datenworkshop mit visueller Dossiersimulation – ShinyViz
Ein überzeugendes Nutzendossier basiert auf einer klaren Datenstrategie. In unserem interaktiven Datenworkshop erarbeiten wir mit Ihnen eine Gesamtstrategie für Ihr HTA-Dossier. Mit unserer visuellen Dossiersimulation (ShinyViz) bereiten wir die verfügbare Evidenz grafisch auf und analysieren unterschiedliche Szenarien, um die beste Strategie für Ihre Nutzenbewertung zu finden.
Datenworkshop mit visueller Dossiersimulation – ShinyViz
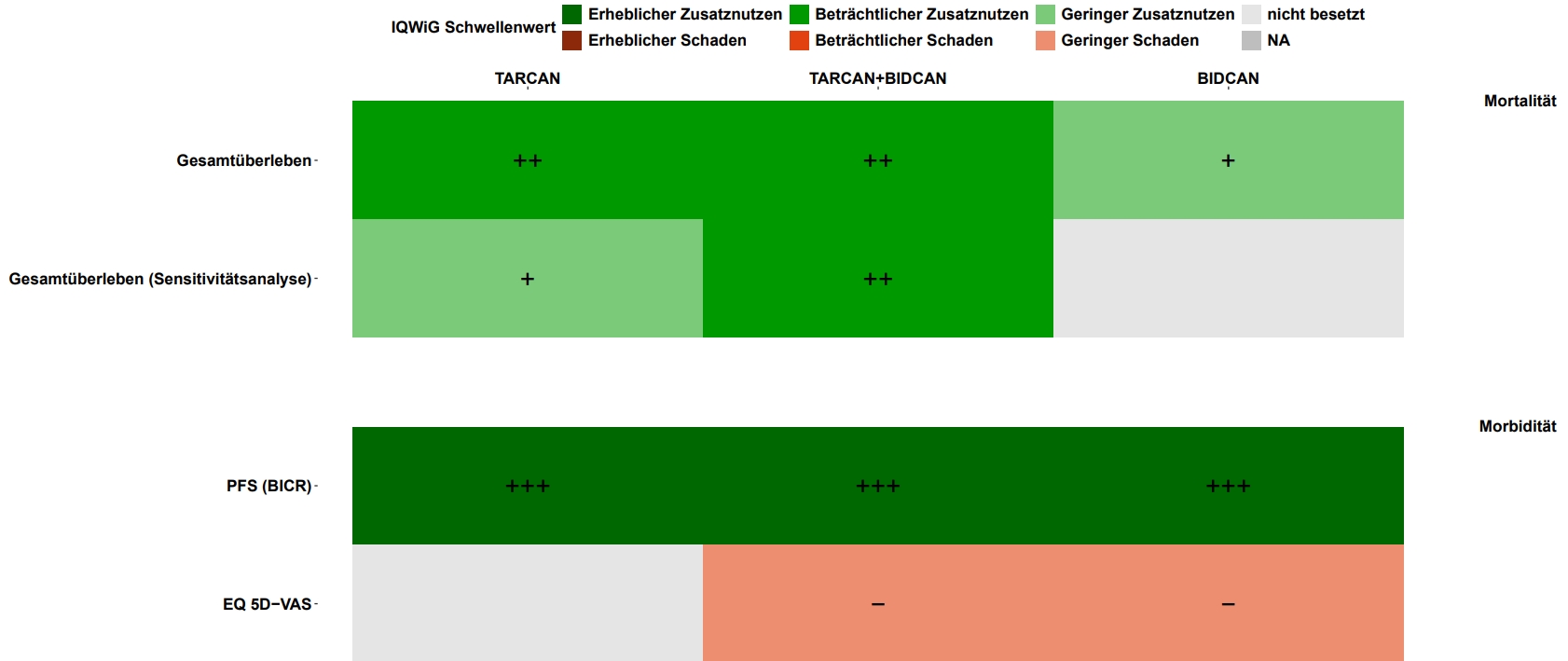
AMNOG-Nutzenbewertung
Als Pionier im Jahr 2010 gestartet, ist AMS heute einer der Marktführer im Bereich der AMNOG-Nutzenbewertung – mit mehr als 300 Dossierprojekten in über 50 Indikationen. Unsere Kundinnen und Kunden schätzen unsere umfassende und tiefgehende statistische Expertise.
Bei uns erhalten Sie alle Leistungen aus einer Hand – von der Planung über sämtliche Analysen bis hin zur aussagekräftigen Aufbereitung und Darstellung im Nutzendossier. Darüber hinaus bieten wir weitreichende Auswertungen für verschiedene Szenarien, um Ihre evidenzbasierte Strategie optimal zu unterstützen.

Europäisches HTA (EU HTA)

Bereits seit 2015 ist AMS im Bereich des EU HTA aktiv. Wir unterstützen Sie bei der Entwicklung eines Evidenzpakets für das EU HTA, indem wir Ihre Datenstrategie gezielt auf die Anforderungen des JCA ausrichten und die Vielfalt der PICO-Kriterien umfassend berücksichtigen. Mehr über unsere Expertise und Leistungen rund um das EU-HTA erfahren Sie hier.
Anwendungsbegleitende Datenerhebung (AbD)
Aufgrund unserer langjährigen Erfahrung sowohl bei klinischen Studien als auch im HTA können wir Sie optimal zur Studienplanung und statistischen Analyse der nicht randomisierten Vergleiche der AbD beraten. Von der Einleitung des Verfahrens über die Erstellung des Studienprotokolls und des statistischen Analyseplans bis hin zur Studiendurchführung, Zwischenanalysen und finaler Auswertung – wir begleiten Sie durch den gesamten Prozess. Mehr über unsere Expertise und Leistungen rund um die AbD erfahren Sie hier.
Publications
- Genet, A., Bogner, K., Goertz, R. et al. Safety analysis of new medications in clinical trials: a simulation study to assess the differences between cause-specific and subdistribution frameworks in the presence of competing events. BMC Med Res Methodol 23, 168 (2023). https://doi.org/10.1186/s12874-023-01985-7
- Gillhaus, Johanna & Goertz, Ralf & Jeratsch, Ulli & Leverkus, Friedhelm. (2017). Surrogatvalidierung durch Korrelation und Surrogate Threshold Effect – Ergebnisse von Simulationsstudien Validation of surrogates by correlation and surrogate threshold effect – Results of simulation studies. GMS Medizinische Informatik, Biometrie und Epidemiologie 2017, Vol. 13(1), ISSN 1860-9171. 13. 12. https://doi.org/10.3205/mibe000168.
- S.Wüstner, S. Hogger, D. Gartner-Freyer, A. Lebioda, K. Schley, F. Leverkus (2022): Clinical Evidence Informing Treatment Guidelines on Repurposed Drugs for Hospitalized Patients During the Early COVID-19 Pandemic: Corticosteroids, Anticoagulants, (Hydroxy)chloroquine, Front Public Health, https://doi.org/10.3389/fpubh.2022.804404
- A. Kisser, J. Knieriemen, A. Fasan, K. Eberle, S. Hogger, S. Werner, T. Taube, A. Rasch (2021): Towards compatibility of EUnetHTA JCA methodology and German HTA: a systematic comparison and recommendations from an industry perspective, Eur J Health Econ, https://doi.org/10.1007/s10198-021-01400-2
Konferenzbeiträge
Bierl M, Niederkofler D, Hogger S, Wüstner S (2023) Successful Use of Propensity Score Methods for HTA Germany: A Near-Impossible Task? Value in Health, 26 (12) Supplement S424, https://doi.org/10.1016/j.jval.2023.09.2216
Referenzen







