Medizinprodukte – Post-Market Clinical Follow-up (PMCF) Studien
Die klinische Bewertung ist ein fortlaufender Prozess und die Einhaltung der Medizinprodukteverordnung 2017/745 schreibt die proaktive Erfassung klinischer Daten für CE‑gekennzeichnete Produkte vor. Ziel ist es, die Sicherheit und Leistung während des gesamten Lebenszyklus des Produkts kontinuierlich zu validieren und gleichzeitig aufkommende Risiken zu erkennen und zu mindern.
AMS ist spezialisiert auf die Durchführung von Post-Market Clinical Follow-up (PMCF)-Studien in Übereinstimmung mit nationalen Gesetzen, Standards der guten klinischen Praxis und Anforderungen der benannten Stellen. Lassen Sie sich bei der Durchführung einer umfassenden PMCF-Studie für Ihr Medizinprodukt unterstützen. So können Sie sicher gehen, dass die gesetzlichen Anforderungen stets eingehalten und die Sicherheit der Patienten und Patientinnen jederzeit gewährleistet ist. Vertrauen Sie uns, wenn es darum geht, die Wirksamkeit und Zuverlässigkeit Ihrer medizinischen Innovationen durch klinische Bewertungen auch nach der Markteinführung zu erhalten.
Dr. Gabriele Feldmann
Clinical Operations Manager
Basierend auf einem soliden wissenschaftlichen Hintergrund in den Bereichen Pathophysiologie und Pathobiochemie widmet sich Gabriele Feldmann seit 30 Jahren der Klinischen Forschung. Ihr umfangreiches Fachwissen erstreckt sich auf internationale Studien in allen Phasen der Produktentwicklung und beinhaltet die Auswahl von Studienzentren, Monitoring und Projektmanagement. Gabriele Feldmann ist Expertin für die klinische Prüfung von Medizinprodukten und betreut Studien mit Medizinprodukten aller Risikoklassen.
Gabriele Feldmann leitet ein Team von AMS Experten, die auf diesen Bereich der Klinischen Forschung spezialisiert sind. Sie bietet kleinen und mittleren Unternehmen individuelle Beratung an und führt sie durch die Planung und Durchführung zulassungsrelevanter Studien und Post-Market Clinical Follow-up (PMCF) Studien. Dank ihrer strategischen Herangehensweise und Praxiserfahrung gelangen auch komplexe Medizinproduktestudien zu einem erfolgreichen Abschluss.
Ihr Engagement für die Weiterentwicklung der Klinischen Forschung, ihre innovativen Lösungen und ihre Qualitäten als Teamplayer machen Gabriele Feldmann zu einem großen Gewinn für das Unternehmen und seine Mission, die Gesundheitsversorgung immer weiter zu verbessern.
Unsere Ansprechpartnerin

Dr. Gabriele Feldmann
Clinical Operations Manager
Unsere Leistungen
Strategische Beratung
Spezialisierte Teams für jede spezifische Indikation: Ein zentraler Teil der Philosophie von AMS ist die Zusammenstellung von Teams aus Spezialisten, die sich auf die Optimierung des therapeutischen Fachwissens in allen Aspekten unserer Dienstleistungen für die Klinische Forschung konzentrieren.
Feasibility
Vor der Finalisierung eines Studienprotokolls legen wir bei AMS großen Wert auf umfassende Machbarkeitsanalysen in verschiedenen Bereichen, denn wir haben erkannt, dass eine gute Feasibility (Machbarkeit) das A und O für den späteren Erfolg einer Studie ist.
Medical Writing
Unser engagiertes Team bietet hervorragende Dienstleistungen im Bereich Medical Writing, die nicht nur wissenschaftlich fundiert, sondern auch auf die jeweiligen Bedürfnisse unserer Kunden und die geltenden gesetzlichen Anforderungen zugeschnitten sind.
Regulatory Affairs
Die regulatorischen Anforderungen an die Arzneimittelentwicklung werden weltweit immer komplexer. Die Expertise des AMS Regulatory-Affairs-Teams und unserer anderen Fachabteilungen kann Sie bei der Planung Ihrer Strategie zur Arzneimittelentwicklung durch diese Anforderungen navigieren.
Data Management
AMS arbeitet nach den CDISC-Datenstandards für die Erhebung von Daten gemäß CDASH und für die Analyse und Übermittlung von Daten gemäß ADaM und SDTM.
AMS-ePRO®
Mit AMS-ePRO®® können die Teilnehmenden in Ihrer Studie jederzeit und von überall ihre Patientendaten erfassen. So erhalten Sie mehr klinisch signifikante Daten und bringen Ihre Studie voran.
Projektmanagement
Die Rolle des Projektmanagers oder der Projektmanagerin ist für den Erfolg einer klinischen Studie von entscheidender Bedeutung. Während Ihres gesamten Projekts arbeiten unsere Projektmanager und Projektmanagerinnen bei AMS proaktiv mit Ihnen und Ihrem Team zusammen und bieten innovative Lösungen zur Bewältigung der Projektherausforderungen.
Monitoring/ Risk-based Monitoring/ Remote and Centralized Monitoring
AMS ist ein führendes Unternehmen in der Klinischen Forschung und verfügt über ein Team engagierter Clinical Research Associates (CRAs) zum Monitoring Ihrer Studie, die in ganz Europa tätig sind und durch globale Kooperationspartner und Partnerinnen verstärkt werden können. Unser Erfolg wird durch das positive Feedback unserer Kunden und Kundinnen immer wieder bestätigt.
Clinical Safety und Pharmakovigilanz
Unsere Experten und Expertinnen der AMS–Abteilungen Clinical Safety und Pharmakovigilanz kommen mit unterschiedlichem Hintergrund aus der Medizin, der Pharmazie und den Naturwissenschaften. Sie begleiten Sie auf dem Weg der Arzneimittelentwicklung durch alle Phasen – von den ersten Schritten bis hin zur Zulassung und Post-Marketing-Projekten.
Biostatistik
Wir bieten alle Dienstleistungen an, die im Lebenszyklus klinischer Entwicklungsprojekte erforderlich sind – beginnend mit der biostatistischen Beratung während der Entwicklung des Projektkonzepts bis hin zu Beiträgen für Einreichungen oder HTA-Dossiers und Studien nach der Zulassung.
AMS-Beratung für die Klinische Forschung und Fachwissen in allen Indikationen
Spezialisierte Teams für jede spezifische Indikation: ein zentraler Teil der AMS-Philosophie ist die Zusammenstellung von Teams aus entsprechenden Spezialisten und Spezialistinnen mit der Zielsetzung, das therapeutische Fachwissen in allen Aspekten unserer Dienstleistungen für die Klinische Forschung stetig zu verbessern.
Unser Team in der Klinischen Forschung bei AMS besteht aus erfahrenen Ärzten und Ärztinnen, zertifizierten Medical Writern sowie qualifizierten Biostatistikern und Biostatistikerinnen sowie Projektmanagern und Projektmanagerinnen, die unsere Kunden im gesamten Verlauf der Studie kontinuierlich begleiten. Hier seien nur einige Bereiche genannt, in denen wir Sie unterstützen:
- Design von klinischen Studien
- Protokollerstellung
- Auswahl von Studienzentren und Patienten
- Medical Review
- Beiträge zum Abschlussbericht aus medizinischer Sicht
Während der wegweisenden frühen Planungsphase Ihrer klinischen Studie leisten die Spezialisten und Spezialistinnen von AMS einen bedeutenden Beitrag zu einem gelungenen Protokolldesign. Diese frühe Planungsphase kann entscheidend sein für den späteren Erfolg Ihrer Studie und das Erreichen Ihrer Entwicklungsziele.

Wenden Sie sich an unsere Spezialisten und Spezialistinnen bei AMS und profitieren Sie von deren Expertise. Die strategische Beratung durch AMS ist eine eigene Dienstleistung, die Sie in der Planungsphase Ihrer Studie in Anspruch nehmen können, noch bevor Sie sich über den Umfang des Outsourcings entschieden haben. Nutzen Sie unsere Fachkenntnisse, um Ihr Studiendesign zu optimieren und die Wahrscheinlichkeit zu erhöhen, dass Sie Ihre Entwicklungsziele erreichen.
Feasibility

Bevor ein Studienprotokoll finalisiert wird, legen wir bei AMS großen Wert auf umfassende Machbarkeitsanalysen in verschiedenen Bereichen, denn wir haben erkannt, dass eine gute Feasibility (Machbarkeit) das A und O ist.
Auf Protokollebene stellt die Feasibility sicher, dass das Studienkonzept mit den entscheidenden Kriterien in Einklang steht, um die globalen und lokalen medizinischen Standards, die Anforderungen der Aufsichtsbehörden und die ethischen Grundsätze zu erfüllen.
Auf Länderebene gewährleistet die Feasibility, dass das Protokoll nationale und regionale Bestimmungen einhält – ein entscheidender Punkt, den es beim Design internationaler Studien zu beachten gilt.
Auf der Ebene der Zentren erhalten wir durch die Feasibility eine verlässliche Einschätzung darüber, ob die anvisierten Zentren in der Lage sind, Protokollanforderungen und Kriterien für die Patientenauswahl zu erfüllen. Eine gut durchgeführte Machbarkeitsstudie hilft bei der Erstellung solider Projektbudgets und Timelines, und trägt zu einer vorhersehbaren Patientenrekrutierung bei. AMS bietet eine Reihe unterschiedlicher Feasibility-Techniken, die sich nahtlos in die klinischen Systeme des entsprechenden Projekts integrieren lassen. Dazu gehören direkte Links zu Managementsystemen für klinische Studien (CTMS) sowie elektronische Datenerfassung (EDC), die insgesamt für eine verbesserte Effizienz der Arbeitsabläufe sorgen.
Wenden Sie sich bereits in der Planungsphase Ihrer klinischen Studie an unsere Feasibility-Experten und Expertinnen, um unsere Unterstützung für Ihr Studiendesign zu nutzen.
Feasibility ist bei AMS eine eigenständige Dienstleistung. So können Sie uns bereits beauftragen, bevor Sie mit dem formalen Outsourcing für die Durchführung Ihrer Studie beginnen. Profitieren Sie von unserer Expertise, um den Erfolg Ihrer klinischen Studie zu erhöhen.
Medical Writing
Medical Writing in der Klinischen Forschung – hier trifft wissenschaftliche Exzellenz auf präzise Kommunikation
Medical Writing bei AMS steht für Klarheit und Relevanz in der Kommunikation. Hinter den herausragenden Leistungen in diesem Bereich steht ein Team engagierter und versierter Medical Writer. Ihre Texte sind nicht nur wissenschaftlich fundiert, sondern auch auf die besonderen Bedürfnisse unserer Kunden und Kundinnen und die geltenden gesetzlichen Anforderungen zugeschnitten. Sie beruhen auf einem tiefgreifenden Verständnis für die unterschiedlichen Bedürfnisse von medizinischen Experten und Expertinnen, Fachleuten im Gesundheitswesen oder medizinischen Laien. Dadurch sind wir in der Lage, komplexe Daten und wissenschaftliche Zusammenhänge so zu vermittelt, dass sie von allen Beteiligten verstanden werden.
Medical Writing für Regulatory Affairs
Wir bieten eine Reihe von Medical-Writing-Dienstleistungen für alle Studiendokumente an, angefangen von der Protokoll-Synopse/Study Outline und dem Protokoll bis zu Dokumenten, die den Patienten und Patientinnen ausgehändigt werden, sowie Studienberichte und wissenschaftliche Publikationen.
Was auch immer Ihre Anforderungen sind, wir haben das Know-How diese zu erfüllen:
- Protokoll-Synopse und deren Zusammenfassung für Laien
- Clinical Study Protocol/ Clinical Investigation Plan/ Clinical Performance Study Plan und entsprechende Amendments/ Modifications
- Patienteninformationen und Einwilligungserklärungen
- Zwischenberichte
- Final Clinical Study Report/ Clinical Investigation Report/ Clinical Performance Study Report
- Zusammenfassung der Studienergebnisse einschließlich einer Version für Laien
- Veröffentlichung von Studienergebnissen in öffentlichen Datenbanken
- Dokumente für DIGA-Fast-Track-Verfahren in Deutschland
- Protokoll und Berichte für die Anwendungsbegleitende Datenerhebung (AbD) in Deutschland

Publikations-Service
Unser Team ist auf die Erstellung wissenschaftlicher Manuskripte für die Publikation in Peer-Reviewed-Journals spezialisiert. Von Originalartikeln bis hin zu Reviews, wir sorgen dafür, dass Ihre Ergebnisse klar, präzise und unter Einhaltung der journalspezifischen Richtlinien kommuniziert werden.
Wir erstellen für Sie:
- Konferenz-Abstracts und Poster
- Manuskripte für Fachzeitschriften
- Begleitung und Zusammenfassung von Advisory Board Meetings
- Marketing Texte
- Schulungsmaterialien
- Foliensätze für mündliche Vorträge oder Schulungen
Unser Team von Spezialisten
Wir sind stolz darauf, dass wir – im Gegensatz zu größeren Agenturen – über eine kleine, eng miteinander vernetzte Gruppe von Experten und Expertinnen verfügen. Dies ermöglicht uns ein hohes Maß an Zusammenarbeit und stellt sicher, dass Ihr Projekt die Aufmerksamkeit erhält, die es verdient.
Dies sind die Vorzüge von AMS:
- Wir besitzen einen reichen Erfahrungsschatz in der Klinischen Forschung
- Wir haben ein umfangreiches Wissen in einem breiten Spektrum an Indikationen – von A wie Autoinjektor bis F wie Familiäre Transthyretin-Amyloid-Polyneuropathie oder U wie ulzerative Kolitis, mit einem Schwerpunkt auf onkologischen Indikationen und Medizinprodukten
- Alle Medical Writer sind Wissenschaftler und Wissenschaftlerinnen – die meisten haben einen weiterführenden Abschluss in naturwissenschaftlichen Fächern
- Teilnahme an Konferenzen und Workshops der European Medical Writers Association (EMWA) und an Fortbildungen von Berufsverbänden wie zum Beispiel der DGPharMed ermöglichen die kontinuierliche Weiterbildung und Schulung zu wichtigen Richtlinien und Vorschriften und sichern so die hohe Qualität der Dienstleistungen
- Durch die enge Zusammenarbeit mit den AMS-Experten und Expertinnen in Clinical Operations und Biostatistik können unsere Medical Writer eine Studie von Beginn an unterstützen und einen wertvollen Beitrag zu deren Erfolg liefern
Maßgeschneiderte Lösungen
Uns ist bewusst, dass jedes Projekt einzigartig ist, und dieses Verständnis spiegelt sich in unserer Herangehensweise. Unabhängig davon, was Sie benötigen – regulatorische Dokumente, Studienberichte, Manuskripte oder andere Medical-Writing Services – wir passen unsere Lösungen an Ihre speziellen Bedürfnisse an.
Projektmanagement

Die Funktion des Projektmanagers ist für den Erfolg jeder klinischen Studie entscheidend. Während Ihres gesamten Projekts stehen unsere Projektmanager und Projektmanagerinnen in engem Kontakt mit Ihnen und Ihrem Team und bieten innovative Lösungen zur Bewältigung von Projektherausforderungen. Unsere Kunden und Kundinnen loben die außergewöhnlich gute Erreichbarkeit und die schnelle Reaktionsfähigkeit unserer Projektmanager und Projektmanagerinnen, Schlüsselelemente für den Projekterfolg. Letztlich trägt dieses Engagement dazu bei, dass solide Budgets aufgestellt werden können, eine hohe Qualität der Studienergebnisse erreicht wird und Timelines eingehalten werden.
Ihr/e engagierte/r AMS-Projektmanager oder Projektmanagerin arbeitet eng mit Ihnen und Ihrem Team zusammen und fungiert als zentrale Anlaufstelle für alle projektbezogenen Aufgaben. Der/die Projektmanager oder Projektmanagerin liefert einen umfassenden Plan für den Verlauf des Projekts einschließlich der entsprechenden Timelines, der moderne Management Tools wie EDC-basierte Berichte und Kollaborationsplattformen, sowie Clinical-Trial-Management-Systeme beinhaltet.
Neben dem/der Projektmanager oder Projektmanagerin kümmert sich ein Team von AMS-Clinical-Trial-Administratoren und Administratorinnen (CTAs) um alle Belange der Projektadministration und leistet wertvolle Assistenzaufgaben für das PM-Team. In den Aufgabenbereich der CTAs fallen die Betreuung des Clinical Trial Management Systes (CTMS), das Aufsetzen und Führen des Trial Master File (eTMF), der Versand von Studienmaterial, die Bereitstellung von Helplines für Prüfärzte und Prüfärztinnen und die Verwaltung der Zahlungen an die Prüfzentren.
AMS hat immer wieder unter Beweis gestellt, dass wir uns an die Timelines halten und regelmäßige Benchmarking-Untersuchungen von CROs bestätigen dies auch zu 100%. Wählen Sie AMS für ein proaktives und effizientes Projektmanagement und der Erfolg Ihrer klinischen Studie ist garantiert.


Systeme
Während Clinical Trial Management Systems (CTMS) und elektronische Trial Master Files (eTMF) bereits Standard sind, bringt der Set-Up, die Implementierung, die Validierung und die Instandhaltung dieser klinischen Systeme einen erheblichen finanziellen Aufwand mit sich, sowohl was Lizenzgebühren angeht als auch Personalausgaben (z. B. Systemadministratoren, Validierungsmanager, etc.). Als Alternative zu Ihrer eigenen eTMF/CTMS-Plattform stellt Ihnen AMS einen eTMF-Service zur Verfügung. Dieser eTMF wird komplett von AMS betreut und erspart Ihnen dadurch Kosten und Personalkapazitäten. Bitte sprechen Sie uns an, um mehr über die bestehenden Optionen zu erfahren.
Unsere Teams arbeiten mit Smenso, einer internen zuverlässigen Projekt Management Plattform für die schlanke Planung, Durchführung und Überwachung von Projekten. Mit Smenso sind wir noch effektiver in der Organisation von Arbeitsabläufen, bei der Fortschrittsbeurteilung von Projekten und der optimalen Zusammenarbeit aller AMS Teams.
Entscheidende Vorteile von Smenso in unseren Projekten:
- Intelligente Personalplanung: Optimierung der Team-Auslastung und Anzeige möglicher Kapazitätsengpässe bevor diese auftreten, Gewährleistung einer effizienten Nutzung der Ressourcen
- Strategische Planung: Mit einer einfachen Planung von Timelines, Milestones und Zielvorgaben für alle Projekte stellen wir die Weichen zum Erfolg
- Reibungslose Zusammenarbeit: Smenso erleichtert die Kommunikation und Koordination der Teams und sorgt dafür, dass jeder informiert und eingebunden ist
Die Partnerschaft mit Smenso ermöglicht eine präzise Umsetzung unserer Projekte und gibt uns das gute Gefühl, sie auch erfolgreich zum Abschluss zu bringen. Durch die innovativen Tools von Smenso liefern wir eindrucksvolle Ergebnisse und gewährleisten dabei während der gesamten Projektdauer ein hohes Maß an Effizienz.
Regulatory Affairs
Die regulatorischen Anforderungen an die Entwicklung von Arzneimitteln werden weltweit immer komplexer. Das AMS-Regulatory-Affairs-Team und unsere anderen Fachbereiche verfügen über die Expertise, um Sie bei der Planung Ihrer Arzneimittelentwicklung durch diese Anforderungen zu führen.
Unsere Kerndienstleistungen beinhalten:
- Antragstellung für klinische Studien
- Erstellen von Essential Documents
- GAP-Analysen im Vorfeld von Einreichungen
- Besprechungen und Teilnahme an Beratungsgesprächen sowie
Erstellung von Briefing-Paketen
Abgedeckt werden alle Studientypen:
- Phase I – einschließlich First In Man (FIM) Design
- Phase II – IV
- Nicht-interventionelle
- Medizinprodukte
- Mandated Safety Studies
- Real World Evidence (RWE)

Data Management

AMS arbeitet nach den CDISC-Datenstandards für die Erhebung von Daten gemäß CDASH und für die Analyse und Übermittlung von Daten gemäß ADaM und SDTM.
AMS verwendet das klinische Datenbankmanagementsystem (CDMS) / Electronic Data Capture (EDC) System Clincase® und Oracle Clinical One für alle Arten von klinischen Studien. Seit 2023 hat AMS im Rahmen einer so genannten CRO Growth Initiative eine Partnerschaft mit Oracle. Je nach Anforderungen der Studie empfiehlt AMS das am besten geeignete EDC-System. Das Medidata Rave®-System kann ebenfalls verwendet werden, wobei das eCRF-Set-up / die Datenbank vom Hersteller selbst entwickelt wird (Medidata).
Darüber hinaus hat AMS ein eigenes elektronisches Patient Reported Outcome System (AMS–ePRO®) für die Online-Erfassung von Patientenfragebögen und Patiententagebüchern entwickelt, das eine direkte Dateneingabe durch die Patienten und Patientinnen selbst über ihre eigenen Endgeräte (Smartphones, Computer, Tablets usw.) ermöglicht.
Für die Kodierung gemäß MedDRA und WHO Drug Dictionary verwendet AMS das System PACE® von Clearight®.
AMS-Validierungsmanager und Validierungsmanagerinnen mit fundiertem Know-how auf dem Gebiet der Computer System Validierung (CSV) stellen die Installation und Nutzung von vollständig validierten AMS-Systemen im Datenmanagement sicher, die den Anforderungen von 21 CFR part 11 entsprechen.
Das AMS-Datenmanagement (DM) bietet alle Dienstleistungen von der Erstellung des eCRF / der Datenbank über die Datenerfassung und -bereinigung bis hin zum Database Lock und der Bereitstellung der Daten für die statistische Analyse.
Unsere Dienstleistungen beinhalten:
- Erstellen und Pflege des eCRF/ der Datenbank
- Programmierung von Edit Checks
- Datenbereinigung und Überprüfung der klinischen Daten
- Query & Discrepancy Management
- Kodierung gemäß WHO-DD und MedDRA-Wörterbuch
- Bearbeitung externer Daten (Import, Datenabgleich)
- Bereitstellung von Reports zu Patientendaten/ zum Status des Studienverlaufs
- Erstellung und Aktualisierung aller DM-Dokumente
- Verwaltung der EDC/ ePRO-Benutzerkonten
- Aufgaben rund um den Database Lock
AMS electronic Patient Reported Outcomes (AMS-ePRO®)
Unterstützung der Klinischen Forschung durch AMS-ePRO®
Mit AMS-ePRO® können die Patienten und Patientinnen jetzt die erforderlichen Daten für Ihre Studie jederzeit und von überall aus eingeben. AMS-ePRO® hilft, die Erfassung klinisch signifikanter Daten zu beschleunigen und Ihre Studie voranzubringen.
In ihrer über 25-jährigen Erfolgsgeschichte hat AMS viele Unternehmen in den Bereichen Pharmazie, Biotechnologie und Medizinprodukte bei der Durchführung klinischer Studien aller Phasen, Indikationen und jeglicher Komplexität unterstützt. Da sich die Klinische Forschung ständig weiterentwickelt und die stärkere Einbindung von Patienten und Patientinnen zunehmend an Bedeutung gewinnt, hat AMS eine eigene elektronische ePRO-Lösung entwickelt.
AMS-ePRO® ist ein vollständig validiertes elektronisches Tool, das nicht nur GCP- und DSGVO-konform, sondern auch flexibel einsetzbar und patientenfreundlich ist, da die Patienten und Patientinnen ihre eigenen Endgeräte benutzen können. AMS-ePRO® wird bereits bei einer Vielzahl von Indikationen genutzt.

Monitoring/ Risk-based Monitoring/ Remote and Centralized Monitoring

AMS ist führend in der Klinischen Forschung und verfügt über ein Team engagierter Clinical Research Associates (CRAs), die in ganz Europa tätig sind und bei Bedarf durch globale Kooperationspartner verstärkt werden können. Unser Erfolg wird durch das positive Feedback unserer Kunden immer wieder bestätigt.
Unsere CRAs bei AMS verfügen über einen großen Erfahrungsschatz in verschiedenen Indikationen, mit einem besonderen Schwerpunkt auf Onkologie und Immunologie. Spezialisierte Teams innerhalb von AMS arbeiten genau nach den Anforderungen der jeweiligen Projektentwicklungsphase und gewährleisten damit maßgeschneiderte Ansätze für optimale Ergebnisse.
Durch die Weiterentwicklung von Monitoring-Strategien zählt AMS seit vielen Jahren zu den Innovationsführern der Branche. Wir haben Verfahren wie Remote Monitoring, zentralisiertes Monitoring und Risk-Based Monitoring nahtlos in unsere Arbeitsprozesse integriert und so sichergestellt, dass sich unsere Monitoring-Strategie mit der Branche mitentwickelt.
Ein vollständig validiertes und benutzerfreundliches Clinical Trial Management Systems (CTMS) erleichtert das Monitoring bei AMS. Die Arbeitsabläufe lassen sich für jedes Studiendesign individuell anpassen. Außerdem bieten wir modernste ePRO®- und Wearables-Technologien, die Ihnen bei Studiendesigns mit dezentraler Datenerfassung und Erhebung von Real-World-Daten ganz neue Möglichkeiten eröffnen.
AMS-Monitoring macht den Unterschied – höchste Leistungsansprüche, basierend auf mehreren Jahrzenten der Innovation und Erfahrung, in dem wir das Monitoring der Klinischen Forschung stets weiterentwickelt haben.
Clinical Safety und Pharmakovigilanz
Unsere Experten und Expertinnen der AMS-Abteilungen Clinical Safety und Pharmakovigilanz kommen aus der Medizin, der Pharmazie und den Naturwissenschaften. Sie vereinen Fachkenntnisse aus den Bereichen Safety Monitoring, Regulatory Compliance, Risikobewertung und Kommunikation und unterstützen Sie bei allen Aufgaben rund um das Thema Safety. Bei der Entwicklung Ihrer Medizinprodukte und In‑Vitro‑Diagnostika haben wir auch stets die vielschichtige Gesetzgebung auf globaler und nationaler Ebene im Blick.
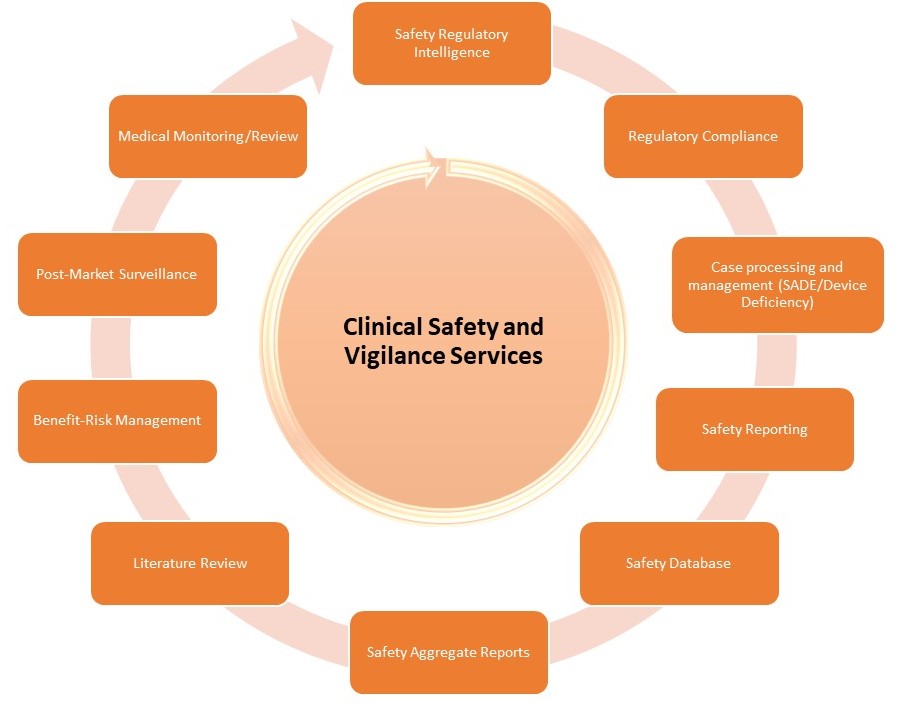
Unser Team deckt im Bereich Clinical Safety das gesamte Leistungsspektrum ab, bietet aber auch maßgeschneiderte Service-Pakete mit folgenden Dienstleistungen:
- Safety Regulatory Intelligence: Zusammenstellung und Zusammenfassung der komplexen Richtlinien und gesetzlichen Vorschriften für jedes beteiligte Land.
- Regulatory Compliance: fristgerechte Vorbereitung und/oder Bereitstellung von Safety Reports unter Einhaltung der für Medizinprodukte und IVD spezifischen regulatorischen Anforderungen einschließlich FDA- und EU-Regelungen, ISO-Standards sowie anderer geltender nationaler Rechtsvorschriften.
Wir sorgen auch für effektive Kommunikationskanäle mit anderen Herstellern, so dass sicherheitsrelevante Informationen schnell weitergeleitet werden.
- Case processing und Management (SADE/ SAE/ Produktmängel [Device Deficiency]/Schwangerschaften): Überprüfung der Minimalkriterien/fehlenden Informationen/Plausibilität/Widersprüchen, Durchführung von medizinischen Checks, Bewertung der Annahmen, Management von Follow-up-Fragen, Dateneingabe und QC in den entsprechenden Datenbanken (einschließlich Coding & Schreiben von Narratives), Erstellen von Standard-Berichtsformularen (MDCG Meldungen, ggf. individuelle Templates), Entblindung, Fall-Tracking und Erstellen von Abgleichs-Listen.
- Safety Reporting: Meldung von Fällen an die zuständigen Behörden, Ethikkommissionen sowie Prüfärzte und Prüfärztinnen, um die Einhaltung der erforderlichen Fristen und Einreichungsanforderungen der lokalen und globalen Gesundheitsbehörden zu gewährleisten.
- Safety Database: Einrichtung und Betreuung.
- Safety Aggregate Reports: Erstellung und Einreichung von vorgeschriebenen, umfangreichen Berichten einschließlich Studienbericht (CSR), Annual Safety Report (ASR), oder ggf. zusammenfassenden Bewertungen.
- Literaturrecherche
- Nutzen-Risiko-Management
- Post-Market Surveillance: Wir bieten Dienstleistungen rund um die Überwachung nach Marktzulassung von Medizinprodukten an, sobald diese einer breiteren Bevölkerungsschicht zugänglich sind. Wir stellen zudem sicher, dass allen Auflagen im Zusammenhang mit Post-Market Safety Reporting Rechnung getragen wird.
- Medical Monitoring/Review: Unsere in allen therapeutischen Bereichen äußerst erfahrenen Ärzte und Ärztinnen sind für die medizinische Überwachung einer Studie verantwortlich, um die mit einer klinischen Studie verbundenen Risiken für die Patienten und Patientinnen zu minimieren, die Sicherheit durch zeitnahes Monitoring optimal zu gewährleisten und die Datenintegrität durch regelmäßige Kontrollen und den Austausch mit den Prüfzentren und dem Sponsor zu maximieren.
- Unsere Ärzte und Ärztinnen stehen für Fragen von Prüfzentren auch außerhalb der Geschäftszeiten zur Verfügung, einschließlich einer 24/7-Erreichbarkeit für medizinische Notfälle, um das Studienteam zu unterstützen und anzuleiten und die Patientensicherheit zu gewährleisten.
- Sie tragen die Verantwortung für die fortlaufende medizinische Beratung und Anleitung der klinischen Studienteams (einschließlich der Monitore und Prüfzentren) bei Fragen im Zusammenhang mit dem Protokoll wie Ein- und Ausschluss von Patienten oder Auslegung des Protokolls.
- Sie beantworten Fragen und bewerten Problemfälle an den Prüfzentren zu Ein- und Ausschlusskriterien, klinische und sicherheitsrelevante Fragen zur Studie, z. B. im Zusammenhang mit dem Medizinischen Prüfprodukt (IMD) oder In-Vitro-Diagnostika (IVD), schwerwiegenden unerwünschten Ereignissen (SAEs) oder schwerwiegenden unerwünschten Produktwirkungen (SADEs) einschließlich des Umgangs mit Produktmängeln (DD), Begleitmedikation, oder Queries mit medizinischer Fragestellung.
Da unsere Expertise im Bereich klinische Sicherheits- und Vigilanzdienste auf den Bereich der Medizinprodukte abgestimmt ist, werden Sie problemlos durch interventionelle Klinische Prüfungen aller Entwicklungsphasen, Nicht-Interventionelle Studien (NIS) und Post Marketing Clinical Follow-Ups (PMCF) geführt.
Biostatistik
Wir bieten Dienstleistungen in allen Stadien klinischer Entwicklungsprojekte an, beginnend mit der biostatistischen Beratung bei der Entwicklung des Projektkonzepts bis hin zu Beiträgen für Einreichungen oder HTA-Dossiers und Studien nach der Zulassung.
Unsere Leistungen beinhalten:
- Biostatistische Beratung und Erstellung von Unterlagen für interventionelle klinische Studien und Beobachtungsstudien
- Fallzahlberechnungen
- Randomisierung (auf Wunsch mit Integration der Randomisierungsliste in das eCRF)
- Unterstützung für/ Teilnahme an Data Monitoring Committees (DMC)
- Biostatistischer Review von/ Mitarbeit an Studienprotokollen/ Studienberichten/ Postern/ Manuskripten
- Umfassende und detaillierte Statistische Analysepläne (SAP)
- SAS-Programmierung für die statistische Analyse, Review Listings, Periodic Safety Reports oder Studienergebnissen, die in die EudraCT-Datenbank eingestellt werden
- Gesundheitsökonomie, Patientenumfragen, Burden of Disease Studies, Kosteneffizienz-Studien, Untersuchungen zur Lebensqualität
- Spezifische Kenntnisse zum innovativen Design klinischer Prüfungen, z. B. adaptive Designs
- Kontinuierliche Schulungen zu allen geltenden Richtlinien sind Teil unseres Qualitätsmanagementsystems
Alle Dienstleistungen werden mit validierten Systemen (SAS, nQuery, Pinnacle 21 Community Validator) unter Einhaltung aller geltenden Richtlinien (z. B., GCP, ICH E3/E9, 21 CFR part 11) durchgeführt.
Nutzen Sie die Erfahrung von AMS und nehmen Sie unsere Hilfe bei der Auswahl des optimalen Studiendesigns und der geeigneten Endpunkte für die Zielsetzung Ihres Projekts an. Wir bieten eine zeit- und kosteneffiziente Durchführung aller Dienstleistungen mit qualitativ hochwertigen Ergebnissen.
Im Rahmen eines Projekts bieten unsere Biostatistiker und Biostatistikerinnen dem Sponsor und dem Projektteam fortlaufende Unterstützung und Beratung. Biostatistik arbeitet dabei eng mit den Fachleuten des Auftraggebers, den Projektmanagern und Projektmanagerinnen, den Datenmanagern und Datenmanagerinnen sowie den medizinischen Monitoren zusammen, um die optimale Lösung für Ihre Anforderungen zu finden.
Referenzen







