Anwendungsbegleitende Datenerhebung (AbD)
Bei seltenen Erkrankungen kann es herausfordernd sein, vergleichende Evidenz vorzulegen, da oft nur begrenzte Studiendaten verfügbar sind. Um diese Evidenzlücke zu schließen, hat die Bedeutung von Real-World Evidence (RWE) im HTA-Prozess zugenommen. Die anwendungsbegleitende Datenerhebung (AbD) ist eine vom G-BA geforderte Form der prospektiven Real-World-Datenerhebung mit dem Ziel, nach der Markteinführung zusätzliche Evidenz zu generieren. Sie dient dazu, Unsicherheiten aus der frühen Nutzenbewertung zu reduzieren und eine belastbare Datengrundlage für eine erneute Nutzenbewertung und Erstattungsbetragsverhandlung zu schaffen. Mit unserer umfangreichen Erfahrung aus mehreren aktuell laufenden AbD-Verfahren und unserem multidisziplinären Ansatz bieten wir Ihnen umfassende Unterstützung und Beratung während des gesamten AbD-Prozesses. Unsere Leistungen umfassen unter anderem die strategische Beratung zu Ihrer Positionierung und deren Umsetzung im AbD-Verfahren, maßgeschneiderte Workshops, die aktive Teilnahme an Beteiligungsverfahren sowie die Erstellung von Studienunterlagen wie Protokoll und statistischem Analysenplan (SAP). In unserem interdisziplinären Team liegt der Fokus auf den Bereichen Biostatistik, Medical Writing, Projektmanagement und klinische Forschung, um Ihre AbD-Studie methodisch und operativ bestmöglich zu begleiten.
Dr. Stefanie Wüstner
Head of Business and Scientific Innovation
Stefanie ist HTA-Expertin mit Schwerpunkt auf systematischen Recherchen, vergleichender Evidenz und strategischer Beratung an der Schnittstelle von klinischer Forschung, Evidenzsynthese und regulatorischen Anforderungen.
Mit einem akademischen Hintergrund in Biowissenschaften und Public Health sowie rund zehn Jahren Erfahrung im Bereich Health Technology Assessment (HTA) begleitet sie pharmazeutische Unternehmen bei der erfolgreichen Positionierung ihrer Produkte - sowohl im deutschen AMNOG-Prozess als auch im Rahmen des europäischen EU HTA.
Als Head of Business and Scientific Innovation verantwortet sie die fachliche Weiterentwicklung interdisziplinärer Teams und entwickelt praxisnahe, innovative Lösungen – von der Automatisierung komplexer Prozesse, über die Anwendung neuer Methoden, bis hin zur Integration neuer Technologien in die tägliche Arbeit.
Sie bringt umfassende Erfahrung in der Planung und Umsetzung von HTA-Dossiers mit, einschließlich der Entwicklung anwendungsbegleitender Datenerhebungen und der Einbindung von Real-World Evidence (RWE) in Bewertungsprozesse. Ihre Fähigkeit, wissenschaftliche Tiefe mit klarer Kommunikation zu verbinden, zeigt sich auch in zahlreichen Publikationen und internationalen Konferenzbeiträgen.
Unsere Ansprechpartnerin

Dr. Stefanie Wüstner
Head of Business and Scientific Innovation
Unsere Leistungen
Setup
Wir unterstützen Sie bei der strategischen Planung Ihrer AbD, von der Budgetierung bis zur gezielten Einbindung relevanter Stakeholder.
Workshops
Unsere maßgeschneiderten Workshops helfen Ihnen, die optimale Vorgehensweise zu entwickeln. Gemeinsam führen wir ein PICO-Scoping durch und identifizieren potenzielle Evidenzlücken mittels GAP-Analyse.
Interaktion mit G-BA und IQWiG
Unsere Expertinnen und Experten begleiten Sie proaktiv durch das Beteiligungsverfahren, unterstützen bei der Erstellung der schriftlichen Stellungnahme zum IQWiG-Konzept und bereiten Sie optimal auf den Fachaustausch vor.
Studiendokumente
Profitieren Sie von der umfangreichen Erfahrung unserer HTA- und Clinical Operations-Expertinnen und Experten bei der Erstellung und Überarbeitung von Studienprotokoll und statistischen Analyseplänen (SAP).
Methodische und strategische Beratung
Wir teilen unsere Erfahrung und unser Fachwissen in Bezug auf die anspruchsvollen methodischen Aspekte der AbD, einschließlich der Berechnung von Patientenzahlen, der systematischen Confounder-Identifizierung, der Erfassung patientenberichteter Endpunkte und der Zusammenarbeit mit Registern.
Durchführung der AbD
Mit Beginn der Datenerhebung unterstützt Sie unser Team. Wir erstellen Statusberichte, Zwischenanalysen sowie die abschließende Auswertung und Interpretation.
Anwendungsbegleitende Datenerhebung (AbD) in der frühen Nutzenbewertung
Seit 2020 kann der G-BA für neue Arzneimittel mit gesonderten Zulassungswegen (bedingte Zulassung oder Zulassung unter außergewöhnlichen Umständen) bzw. Orphan Drugs eine anwendungsbegleitende Datenerhebung (AbD) fordern, wenn keine ausreichende Evidenz für die Bewertung des Nutzens und Zusatznutzens vorliegt.

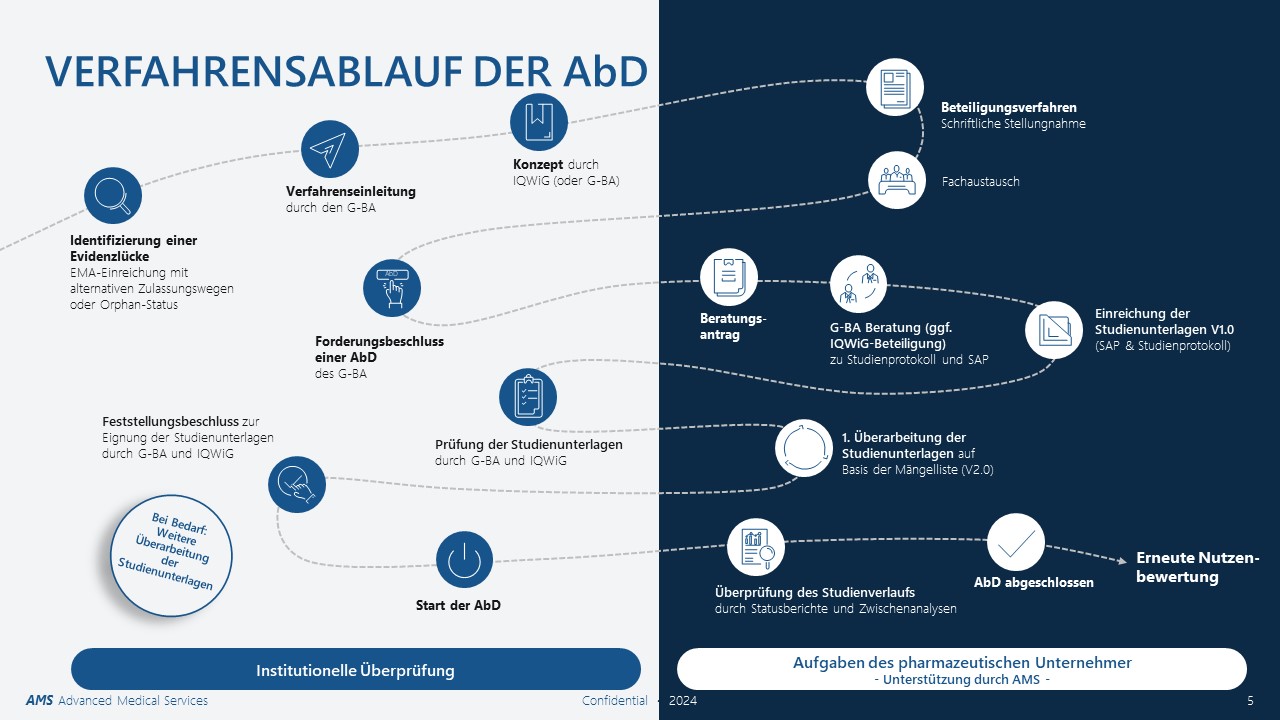
Verfahrensablauf der AbD: Wann passiert was?
Das AbD-Verfahren wird im 5. Kapitel der Verfahrensordnung des G-BA beschrieben und umfasst mehrere Prozessschritte. Zentral sind unter anderem die Entwicklung eines AbD-Konzepts durch das IQWiG und die schriftliche Stellungnahme des pharmazeutischen Unternehmens. Sollte daraufhin eine AbD gefordert werden, muss das pharmazeutische Unternehmen Studienunterlagen (SAP und Studienprotokoll) einreichen, die die Methodik der AbD beschreiben. Nach Abschluss der AbD erfolgt eine erneute Nutzenbewertung des Arzneimittels.
Conference Abstracts
- Bogner K, Ebentheuer LM, Reiter B, Bierl M, Wüstner S (2024) Lessons Learned from Confounder Identification: Insights from German HTA Procedures, Value in Health, 27 (6), S273, https://doi.org/10.1016/10.1016/j.jval.2024.03.1506
-
Bierl M, Niederkofler D, Hogger S, Wüstner S (2023) Successful Use of Propensity Score Methods for HTA Germany: A Near-Impossible Task? Value in Health, 26 (12) Supplement S424, https://doi.org/10.1016/j.jval.2023.09.2216
-
Bogner K, Ebentheuer LM, Wegener M, Wüstner S (2023) Real World Evidence in German HTA: The Challenges of Comparative Routine Practice Data Collection (ABD) for Early Benefit Assessment (AMNOG) Value in Health, 26 (12), S386, https://doi.org/10.1016/j.jval.2023.09.2025
Referenzen







