Europäischer HTA-Prozess
Bereits seit 2015 gestaltet AMS durch regelmäßige Beiträge auf Kongressen, Teilnahme an EUnetHTA-Veranstaltungen und als EUCOPE-Mitglied den EU HTA-Prozess aktiv mit. Unsere bereits gewonnene praktische Erfahrung und profunde Expertise im Rahmen der Erstellung und Einreichung von rapid REA Submission Files während der EUnetHTA Joint Action 3 bringen Sie gut vorbereitet und sicher durch den EU HTA-Prozess.
Unsere Leistungen
- Capability matching
Für eine effiziente Vorbereitung Ihrer relevanten Funktionen (Clinical Development, Regulatory Affairs, Market Access) auf den EU HTA-Prozess erstellen wir gemeinsam mit Ihnen ein individuelles Playbook, das mittels Dry Runs weiter optimiert werden kann. - Training
Wir teilen unser Wissen gerne mit Ihnen im Rahmen von individuellen Workshops, durch Präsentationen und Veröffentlichungen und machen Sie fit für den EU HTA-Prozess. - Vorbereitung früher Beratungen
Wir unterstützen Sie bei der Erstellung der Briefing-Dokumente für die europäische Beratung (JSC), für eine Parallel Consultation (EMA/HTA-Behörden) oder nationale Beratung. - Antizipation möglicher Assessment Scopes
Unter Berücksichtigung verschiedener Möglichkeiten für den Assessment Scope entwickeln wir mit Ihnen die jeweilige Value Story für Ihr Produkt. - Genaue Kenntnisse europäischer HTA-Anforderungen
Wir beraten Sie gerne zur Evidenzgenerierung (z.B. Studiendesign, Endpunkte, Subgruppen- oder Sensitivitätsanalysen, Netzwerk-Meta-Analysen, Surrogatvalidierung, indirekte Vergleiche). - Wissenschaftliche, strategische und methodologische Beratung
Gemeinsam mit Ihnen entwickeln wir die Datenstrategie und nutzen Visualisierungstechniken, um Entscheidungsprozesse zu unterstützen und zu beschleunigen. - Erstellung eines EU HTA-Dossiers
In enger Abstimmung mit Ihnen erstellen wir ein wissenschaftlich fundiertes und strategisch ausgefeiltes EU HTA-Dossier, um mit dem JCA die bestmögliche Voraussetzung für die Preisgestaltung auf Länderebene zu erreichen. - Parallele Erstellung von EU HTA- und AMNOG-Dossier
Durch unsere Erfahrung mit parallelen Verfahren können wir Sie auch planerisch durch die nationalen und EU HTA-Prozesse begleiten.
Umstellung vom Länder- auf das EU HTA: wann kommt was?
Ab Januar 2025 wird die Verordnung über die europäische Bewertung von Gesundheitstechnologien umgesetzt. Die klinischen Domänen eines HTA von neu zugelassenen Arzneimitteln werden danach auf europäischer statt auf nationaler Ebene erstellt: das EU HTA. Für verschiedene Arzneimittel wird die Nutzenbewertung auf EU-Ebene (Joint Clinical Assessments, JCA) zu unterschiedlichen Zeitpunkten obligatorisch. Ab 2030 sind JCAs schließlich für alle Arzneimittel verpflichtend.
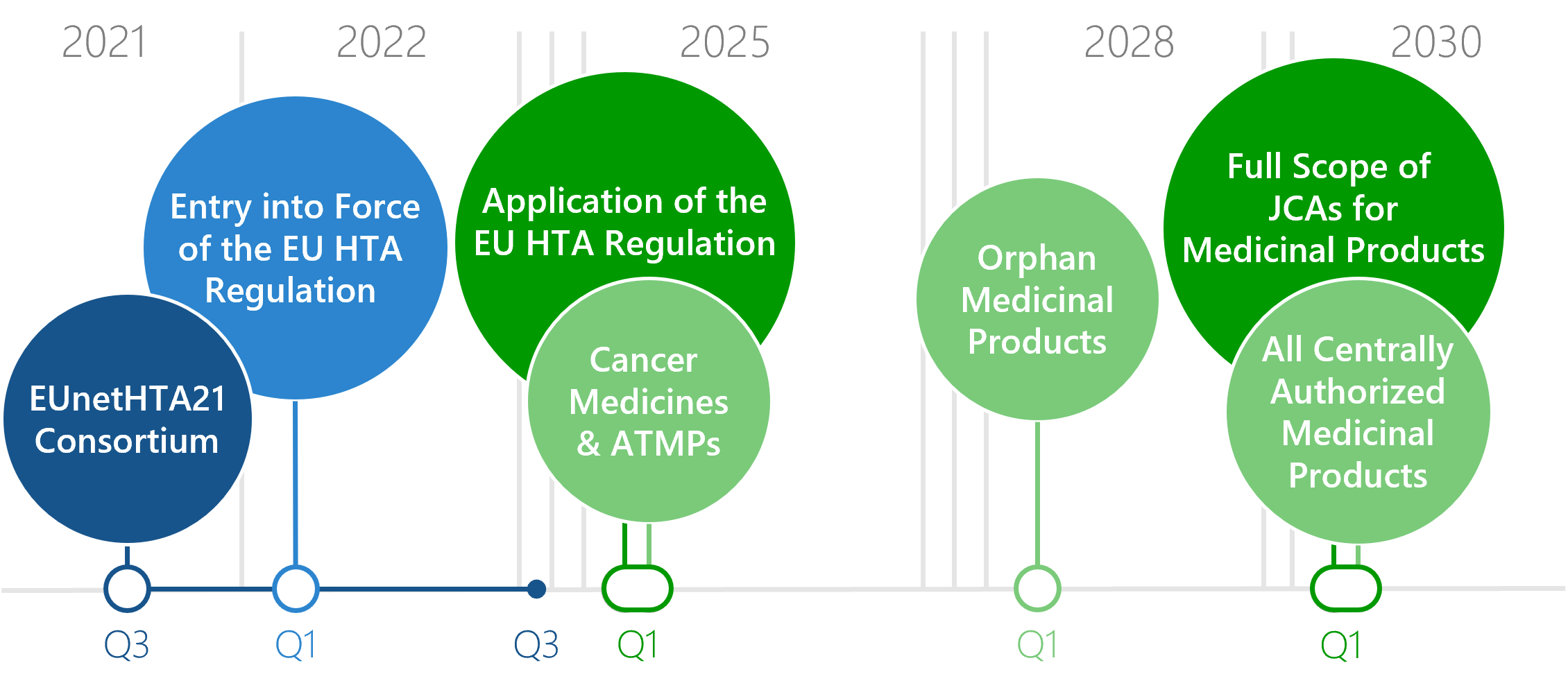
Download: Flyer Timelines Inkrafttreten des EU HTA
Ablauf eines JCA in der europäischen Nutzenbewertung
Das JCA-Verfahren wird von der HTA-Koordinierungsgruppe der Mitgliedstaaten überwacht. Das JCA-Dossier ist 45 Tage vor der CHMP Opinion erforderlich und wird spätestens 30 Tage nach der Marktzulassung des Arzneimittels durch die EMA veröffentlicht. Vor der Einreichung des Dossiers wird ein Scoping-Prozess durchgeführt. Die Ergebnisse dieses Prozesses bilden die Forschungsfrage und den Bewertungsumfang für das Dossier. Der Scoping-Prozess zielt darauf ab, die PICOs (Population, Intervention, Comparator, Outcomes) zu definieren, die den Rahmen für die Bewertung und die Datenanforderungen an den Hersteller festlegen.
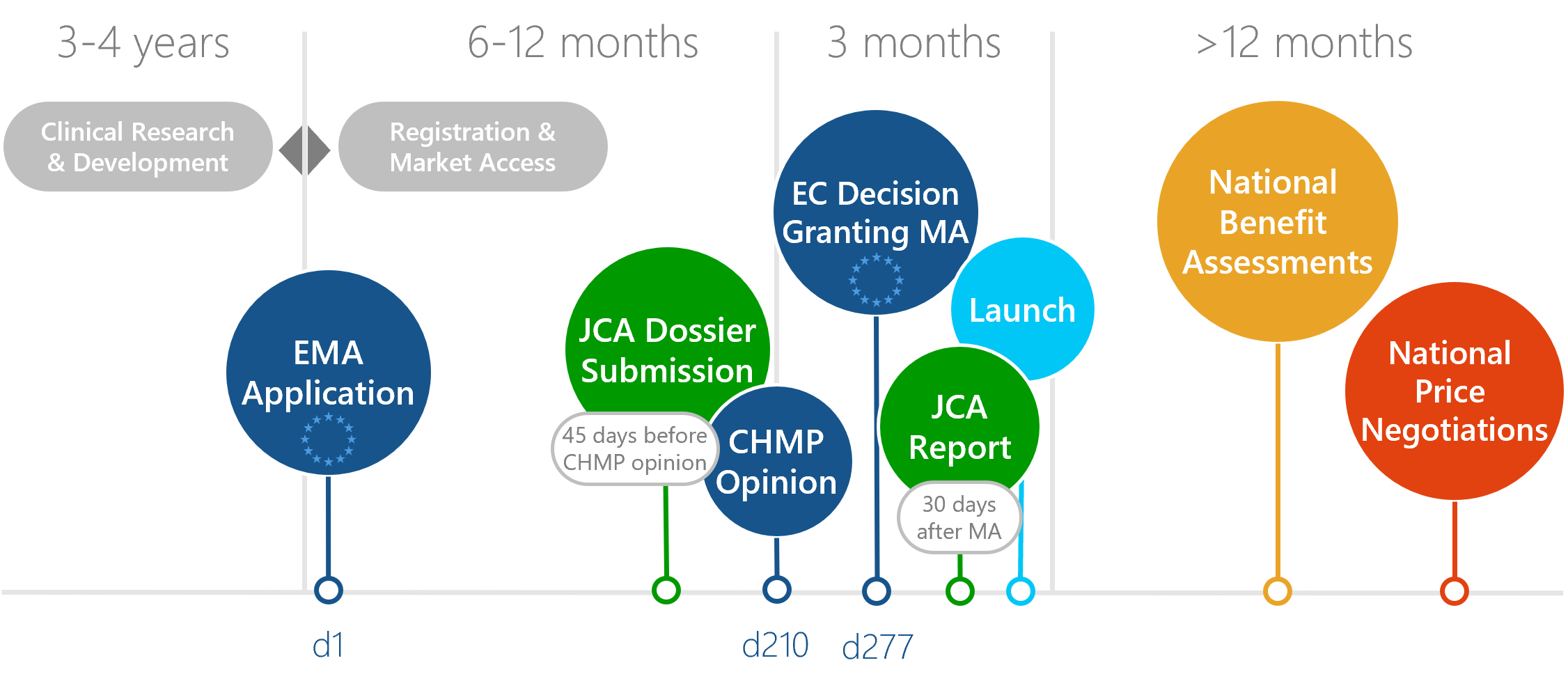
Download: Flyer Ablauf europäischer Nutzenbewertungen
Publikationsliste
Originalartikel in Fachzeitschriften
- Schweitzer MK, Dold MN, Genet A, Gossens K, Klein-Hessling T, Löffler N, Rabel M, Rasch A, Reuter EM, Schmelcher J, Wolfram N, Werner S (2023). Shaping a suitable EU HTA dossier template: why the German template is not fit for purpose. Eur J Health Econ. 2023 Oct 16. doi: 1007/s10198-023-01631-5
- Schweitzer MK, Dold MN, Genet A, Gossens K, Klein-Hessling T, Löffler N, Rabel M, Rasch A, Schmelcher J, Werner S, Wolfram N (2023). Auswirkungen der neuen Dossieranforderungen Monitor Versorgungsforschung 03/23, p26–30, doi: http://doi.org/10.24945/MVF.03.23.1866-0533.2500
- Genet A, Bogner K, Goertz R, Böhme S, Leverkus F (2023). Safety analysis of new medications in clinical trials: A simulation study to assess the differences between cause-specific and subdistribution frameworks in the presence of competing events. Research Square. doi: 21203/rs.3.rs-2475247/v1
- Kisser A, Knieriemen J, Fasan A, Eberle K, Hogger S, Werner S, Taube T, Rasch A (2022). Towards compatibility of EUnetHTA JCA methodology and German HTA: a systematic comparison and recommendations from an industry perspective. Eur J Health Econ 23(5):863-878, doi: 1007/s10198-021-01400-2
- Wüstner S, Hogger S, Gartner-Freyer D, Lebioda A, Schley K, Leverkus F (2022). Clinical Evidence Informing Treatment Guidelines on Repurposed Drugs for Hospitalized Patients During the Early COVID-19 Pandemic: Corticosteroids, Anticoagulants, (Hydroxy)chloroquine. Front Public Health 18;10:804404, doi: 3389/fpubh.2022.804404
- Schomaker M, Hogger S, Johnson LF, Hoffmann CJ, Bärnighausen T, Heumann C (2015). Simultaneous Treatment of Missing Data and Measurement Error in HIV Research Using Multiple Overimputation. Epidemiology. 26(5):628-36. doi: 1097/EDE.0000000000000334
Weitere Publikationen (Workshops/Webinare/Präsentationen/Cenference Abstracts)
- AMS (Eberle K), EUCOPE (2022) European HTA: What have we learned, what lies ahead?, Webinar, Information on EUCOPE website
- AMS & Vfa (2021) New requirements for AMNOG-dossiers: Investigation of considered evaluations in the context of the benefit assessment by IQWiG and G-BA, Report, Information on Vfa website
- Panni, T., Thiele, A., Carls A., Wallstab, A., Eberle, K. & Schleibner S (2018) PHP281 - THE METHODOLOGICAL DIFFERENCES OF EUROPEAN JOINT ASSESSMENT AND GERMAN HTA: AN EMPIRICAL APPROACH. Value in Health 21, p197-S8. https://doi.org/10.1016/j.jval.2018.09.1175
- Rüther A, Herrmann K, Hebborn A, Perleth M, Schwarzer R, Schürmann C, et al. HTA und aktuelle Herausforderungen: Harmonisierung, Real World Data und Surrogatparameter. HTA – How to tackle pressing challenges: International Harmonization, Real World Data, and Surrogates. GMS Medizinische Informatik, Biometrie und Epidemiologie. 2018;Vol. 14(1). https://dx.doi.org/10.3205/mibe000180
- Panni, T., Eberle, K., Seiler, N., Brüderl, M., Burkert-Kautzsch C, Carls A, et al. (2017) VP181 From National To European Assessment - The German Case. International Journal of Technology Assessment in Health Care, 33(S1), 234-5, https://doi.org/10.1017/S0266462317004147
- Hemmerling J, Eberle, K., Hogger S, Gupta M, Ullraum, A, & Seemüller S (2017) PP096 European Union-Health Technology Assessments For Medical Devices - How To Overcome Reimbursement Divergence. International Journal of Technology Assessment in Health Care, 33(S1), 116-117. https://doi.org/10.1017/S0266462317002616
- Gerlinde Jänel. Europäisches und nationales HTA – gleiches Ziel, gleiche Methodik? European and National – same aim, same method? HEC 2016: Health – Exploring Complexity. Joint Conference of GMDS, DGEpi, IEA-EEF, EFMI. München, 28.08.-02.09.2016. Düsseldorf: German Medical Science GMS Publishing House; 2016. DocAbstr. 876-2 https://dx.doi.org/10.3205/16gmds100



